CONCENTRACIÓN DE SOLUCIONES
CONCENTRACIÓN DE SOLUCIONES
La concentración de las soluciones es la cantidad de soluto contenido en una cantidad determinada de solvente o solución.
Las soluciones se dividen en:
*Empíricas o cualitativas:
-En base a soluto
-En base a propiedades fisicoquímicas
*Valoradas
-Molaridad
-Normalidad
-Solución Porcuntual
-Partes por millon

Las soluciones se dividen en:
*Empíricas o cualitativas:
-En base a soluto
-En base a propiedades fisicoquímicas
*Valoradas
-Molaridad
-Normalidad
-Solución Porcuntual
-Partes por millon
EMPÍRICAS O CUALITATIVAS
- EN BASE A SOLUTO
a) Diluida: Presentan poco soluto y mucho solvente
b) Concentrada:El solvente contiene la cantidad de soluto que debe ser
c) Saturada: Más solvente que soluto
d) Sobre saturada: El soluto ya no se puede disolver
-EN BASE A PROPIEDADES FISICOQUÍMICAS
a) Disoluciones
b) Colides
c) Suspenciones

VALORADAS O CUANTITATIVAS
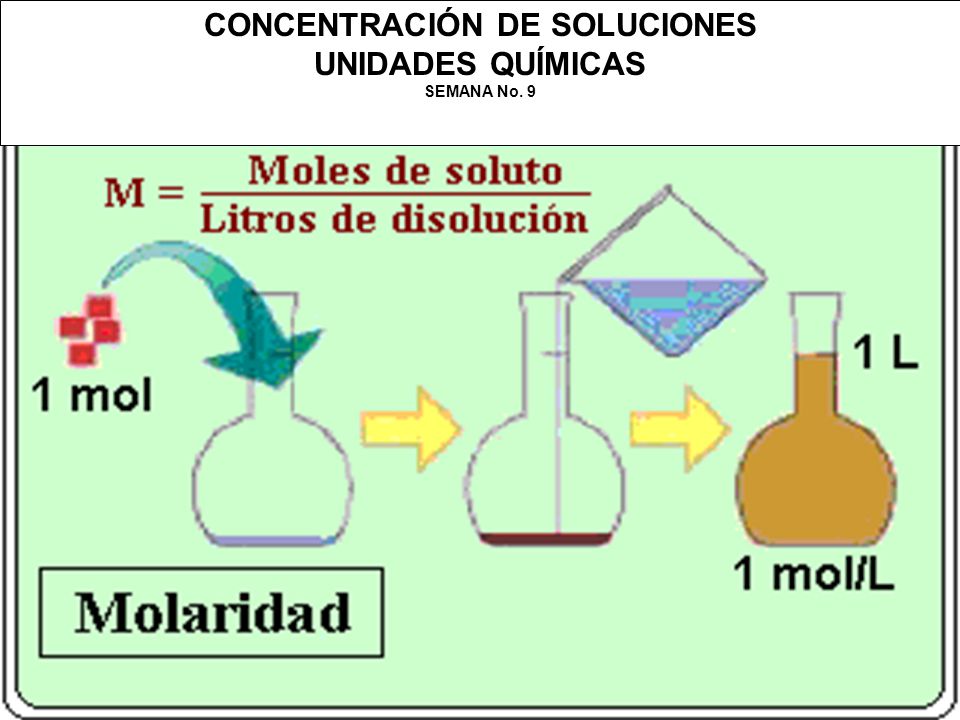
Molaridad (M): Cantidad de moles de soluto por litros de solución
Los términos diluidos o concentrados expresan concentraciones relativas. Para expresar con exactitud la concentración de las soluciones se usan sistemas como los siguientes:
a) Porcentaje peso a peso (% M/M): indica el peso de soluto por cada uno de los gramos de la solución.
a) Porcentaje peso a peso (% M/M): indica el peso de soluto por cada uno de los gramos de la solución.
b) Porcentaje volumen a volumen (% V/V): se refiere al volumen de soluto (litros) por cada litro de solución.
c) Porcentaje peso a volumen (% P/V): indica el número de gramos de soluto que hay en determinados litros de solución.
Partes por millon (ppm): se utiliza comúnmente para cantidades muy pequeñas.




Comentarios
Publicar un comentario